Číslo 3 / 2024
Klinická studie ScrePAN
Duktální adenokarcinom slinivky břišní patří mezi nádorová onemocnění s nejhorší prognózou. Mortalita se u tohoto onemocnění téměř rovná incidenci.
Úvod
V České republice má incidence duktálního adenokarcinomu pankreatu (PDAC – pancreatic ductal adenocarcinoma) vzestupný trend, v roce 2017 bylo hlášeno 21,2 nových případů na 100 000 osob, v absolutním počtu to je 2 233 osob, což oproti datům ze 70. let 20. století představuje více než dvojnásobný vzestup.
Karcinom pankreatu (CaP) je spojen s extrémně špatnou prognózou z několika důvodů. Obvykle je diagnostikován v pokročilém stadiu, což je dáno často asymptomatickým průběhem onemocnění nebo nespecifickými symptomy (pocit nadýmání, jídlo mi nedělá dobře, pocit těžkosti, netrávení, střídání zácpy, průjem) a nedostatkem senzitivních a specifických nádorových markerů. Špatná prognóza tohoto onemocnění je také dána omezenými možnostmi screeningu a kurativní intervence pro krátký „lead time“ při rychle metastazujícím onemocnění.
Vznik adenokarcinomu pankreatu
CaP vzniká z prekurzorových stadií, tzv. prekanceróz, jichž v současnosti známe několik s různým potenciálem malignizace a různým histologickým nálezem. Jsou to:
- intraduktální tubulopapilární neoplazie (ITPN);
- intraduktální papilární mucinózní neoplazie (IPMN);
- pankreatická intraepitelová neoplazie (PanIN);
- mucinózní cystická neoplazie (MCN);
- solidní pseudopapilární neoplazie (SPN);
- serózní mikrocystický adenom (SMCA).
Vývoj prekurzoru do invazivní formy CaP trvá dle modelů přibližně 11 let. Z toho vyplývá dostatečný časový interval pro včasnou diagnostiku.
Teoretická východiska screeningu PDAC
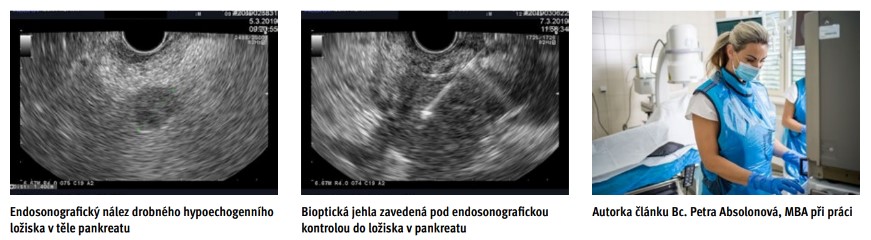
Předpokladem pro účinný screening je kromě detekce časného stadia CaP zejména detekce dysplastických prekurzorových lézí (PanIN2, PanIN3, IPMN). Vyšetřovací metodou, v případě změn na parenchymu slinivky a malých tumorů již od 5 mm, dosahující vyšší přesnosti ve srovnání s CT je endosonografie (EUS) slinivky. Výhodou EUS proti jiným zobrazovacím metodám (MR, CT) je možnost cíleného odběru vzorku ze suspektního ložiska pomocí tenkojehlové biopsie. Recentní metaanalýza hodnotící diagnostickou přesnost EUS s biopsií v detekci CaP poukazuje na vysokou senzitivitu (89 %) a specifitu (96 %) metody.
Psychologický aspekt screeningu karcinomu pankreatu
Vědomí vysokého rizika rozvoje CaP způsobuje obavy a úzkost, tito lidé čelí vysoké psychické zátěži. Pacienti, kteří jsou v „riziku“ vzniku CaP a jsou zařazeni do screeningového programu, vnímají obavu z malignity méně, reálně vnímají snížení rizika vzniku pokročilého nádoru a možnost včasného odhalení.
Aktuální situace v Masarykově onkologickém ústavu
Screening, který se provádí v Masarykově onkologickém ústavu (MOÚ), je zaměřen na osoby, které jsou v riziku, přičemž dle kategorie rizika jsou zařazeny do konkrétních ramen.
Tento pilotní screening se nazývá ScrePAN.
Současně při využití screeningu u rizikových osob nesmíme zapomínat na sporadický vznik PDAC v populaci, která se do rizika dostává z důvodu kouření (které má mimo jiné prokazatelný vliv na nádorová onemocnění obecně), obezity, výskytu CaP v rodině, letitého průběhu chronické pankreatitidy, věku > 55 let a konzumace alkoholu. Víme také o vztahu CaP k diabetu (nově vzniklého a nereagujícího na léčbu) – v tu chvíli by měl diabetolog poslat pacienta na gastroenterologické pracoviště. Přibližně v 90 % se jedná o sporadický karcinom, tedy „náhodně“ vzniklý, a přibližně v 10 % o karcinom genetického původu.
Cíle studie ScrePAN
Cílem studie ScrePAN je snížení incidence CaP preventivním vyšetřováním rizikových skupin pacientů s předpokladem, že čím časněji bude CaP diagnostikován, tím větší jsou šance pacienta na radikální řešení.
Přehled známých a možných rizik i přínosů ScrePAN
Účast ve studii umožní osobám s vysokým rizikem vzniku PDAC:
- absolvovat bezplatně cyklické preventivní kontroly a specializovaná vyšetření, z nichž některé jsou součástí několika výzkumných projektů.
Předpokládané přínosy
- významně zvýší možnosti včasné diagnostiky CaP a přednádorových stavů;
- kurativní chirurgická léčba;
- vyhodnocení přínosu screeningového programu statistickou analýzou.
Praktický průběh
- odběry periferní krve;
- zobrazovací vyšetření bez radiační zátěže (EUS, MR);
- informace klientům v rámci standardních informovaných souhlasů.
Primární cíle ScrePAN
- Implementace screeningového programu PDAC.
- Časná diagnostika PDAC v populaci osob s vysokým rizikem jeho vzniku.
Sekundární cíle ScrePAN
- Metodika liquid biopsy – izolace volné cirkulující DNA (cfDNA). Liquid biopsy představuje minimálně invazivní nástroj v diagnostice maligních nádorů, má silný potenciál v časném rozpoznání nádorů.
- Metodou digitální polymerázové řetězové reakce (ddPCR) stanovení přítomnosti mutace v genu K-RAS.
- Identifikace eventuálních dalších diagnostických/prognostických biomarkerů, mj. stanovování lipidomického profilu jednotlivých skupin osob.
- Srovnání výtěžnosti metod: MR vs. EUS.
- Analýza nákladové efektivity jednotlivých screeningových vyšetření.
Studijní populace
Účastníci studie jsou rozdělení na rameno A a B. Rameno A tvoří pacienti s chronickým onemocněním slinivky v rámci cystické fibrózy a/nebo chronické pankreatitidy, rameno B osoby s dědičnou predispozicí k nádorovým onemocněním:
B1:
- Peutz-Jeghersův syndrom (mutace STK11);
- syndrom familiárního melanomu (mutace CDKN2A);
- hereditární pankreatitida (mutace PRSS1).
B2:
- osoby s potvrzenou diagnózou dědičných syndromů plus jeden příbuzný I. nebo II. stupně s diagnózou:
- PDAC v rodinné anamnéze;
- Lynchův syndrom;
- HBOC (mutace v genech BRCA1, BRCA2, PALB2, ATM);
- FAP (mutace v genu APC);
- Li-Fraumeniho syndrom (mutace v genu TP53).
Třetí rameno C tvoří osoby s pozitivní rodinnou anamnézou PDAC bez prokázaného dědičného syndromu a PDAC u nejméně dvou příbuzných I. nebo II. stupně ve stejné linii.
Závěr
Screening CaP doposud nebyl plošně zaveden do klinické praxe. Z předběžných výsledků podobných programů prováděných v zahraničí vyplývá, že CaP lze u rizikových osob odhalit včas, pokud jsou pravidelně sledovány. Různé riziko vyžaduje různé sledování. Vzhledem k mortalitě CaP, která se téměř rovná incidenci a silně nabývá vzestupného trendu, je vhodné, aby v ČR byli pacienti s rodinným CaP nebo známým hereditárním syndromem podrobně sledováni a vyšetřeni na specializovaném pracovišti.
PDAC představuje a bude představovat jednu z hlavních výzev medicíny dneška a blízké budoucnosti. Kromě snahy o nalezení lepších léčebných prostředků je zásadní prevence vzniku a snaha o včasnou diagnostiku této choroby.
Organizovaný screening vysoce rizikových skupin osob představuje první krok ke zlepšení současné špatné situace. Účast vhodných osob v počínajících screeningových programech, jako je např. ScrePAN, organizovaný na MOÚ a aktuálně se rozšiřující multicentricky v rámci ČR, je tudíž velmi žádoucí.

Literatura
1. CANTO M. I., ALMARIO J. A., SCHULICK R. D. et al. Risk of neoplastic progression in individuals at high risk for pancreatic cancer undergoing long-term surveillance. Gastroenterology 2018; 155(3): 740–751.e2. doi: 10.1053/j.gastro.2018.05.035.
2. CORRAL J. E., MARETH K. F., RIEGERT-JOHNSON D. L. et al. Diagnostic yield from screening asymptomatic individuals at high risk for pancreatic cancer: a meta-analysis of cohort studies. Clin Gastroenterol Hepatol 2019; 17(1): 41–53. doi: 10.1016/j.cgh.2018.04.065.
3. DBOUK M., KATONA B. W., BRAND R. E. et al. The multicenter cancer of pancreas screening study: impact on stage and survival. J Clin Oncol 2022; 40(28): 3257–3266. doi: 10.1200/JCO.22.00298.
4. GOGGINS M., OVERBEEK K. A., BRAND R. et al. Management of patients with increased risk for familial pancreatic cancer: updated recommendations from the International Cancer of the Pancreas Screening (CAPS) Consortium. Gut 2020; 69(1): 7–17. doi: 10.1136/gutjnl-2019-319352.
5. CHARI S. T., LEIBSON C. L., RABE K. G. et al. Pancreatic cancer-associated diabetes mellitus: prevalence and temporal association with diagnosis of cancer. Gastro-enterology 2008; 134(1): 95–101. doi: 10.1053/j.gastro.2007.10.040.
6. CHEN W., BUTLER R. K., LUSTIGOVA E. et al. Validation of the enriching new-onset diabetes for pancreatic cancer model in a diverse and integrated healthcare setting. Dig Dis Sci 2020; 66(1): 78–87. doi: 10.1007/s10620-020-06139.
7. NAUDIN S., VIALLON V., HASHIM D. et al. Healthy lifestyle and the risk of pancreatic cancer in the EPIC study. Eur J Epidemiol 2020; 35(10): 975–986. doi: 10.1007/s10654-019-00559-6.
8. PANNALA R., LEIRNESS J. B., BAMLET W. R. et al. Prevalence and clinical profile of pancreatic cancer-associated diabetes mellitus. Gastroenterology 2008; 134(4): 981–987. doi: 10.1053/j.gastro.2008.01.039.
9. SAWHNEY M. S., CALDERWOOD A. H., THOSANI N. C. et al. ASGE guideline on screening for pancreatic cancer in individuals with genetic susceptibility: summary and recommendations. Gastrointest Endosc 2022; 95(5): 817–826. doi: 10.1016/j.gie.2021.12.001.
10. SHARMA A., CHARI S. T. Pancreatic cancer and diabetes mellitus. Curr Treat Opinions Gastroenterol 2018; 16(4): 466–478. doi: 10.1007/s11938-018-0197-8.
11. TERSMETTE A. C., PETERSEN G. M., OFFERHAUS G. J. et al. Increased risk of incident pancreatic cancer among first-degree relatives of patients with familial pancreatic cancer. Clin Cancer Res 2001; 7(3): 738–744.
12. TRNA J., KUNOVSKÝ L. Screening a prevence duktálního adenokarcinomu pankreatu. In: TRNA J., KALA Z., KUNOVSKÝ L. et al. Klinická pankreatologie. 2. přeprac. a dopl. vyd. Praha: Maxdorf 2021.
13. YOUSAF M. N., CHAUDHARY F. S., EHSAN A. et al. Endoscopic ultrasound (EUS) and the management of pancreatic cancer. BMJ Open Gastroenterol 2020; 7(1): e000408. doi: 10.1136/bmjgast-2020-000408.
14. YU J., BLACKFORD A. L., DAL MOLIN M. et al. Time to progression of pancreatic ductal adenocarcinoma from low-to-high tumour stages. Gut 2015; 64(11): 1783–1789. doi: 10.1136/gutjnl-2014-308653.
15. ZAVORAL M., LACLAV M. Screening karcinomu pankreatu. In: ŠPIČÁK J. et al. Novinky v gastroenterologii a hepatologii II. 1. vyd. Praha: Grada 2017: 23–34.
Bc. Petra Absolonová, MBA
doc. MUDr. Jan Trna, Ph.D.
Masarykův onkologický ústav, Brno
Další články v tomto čísle
- Editorial
- Cena Alice Garrigue Masarykové za mimořádně významné zásluhy v ošetřovatelství
- Nové specializační vzdělávání v oboru hojení ran
- Migréna – když bolest hlavy řídí váš život
- Pacientská organizace Migréna-help
- Spánek a jeho základní poruchy
- Popáleniny – závažný úraz všetkých vekových skupín
- Role Informační a edukační poradny podpůrné péče v rámci Komplexního onkologického centra v Plzni
- Nové poziční dokumenty pro hojení ran EWMA
- Emoce a mikrobiom nás všech – jiný pohled na léčbu ran